Titration | Umweltanwendung
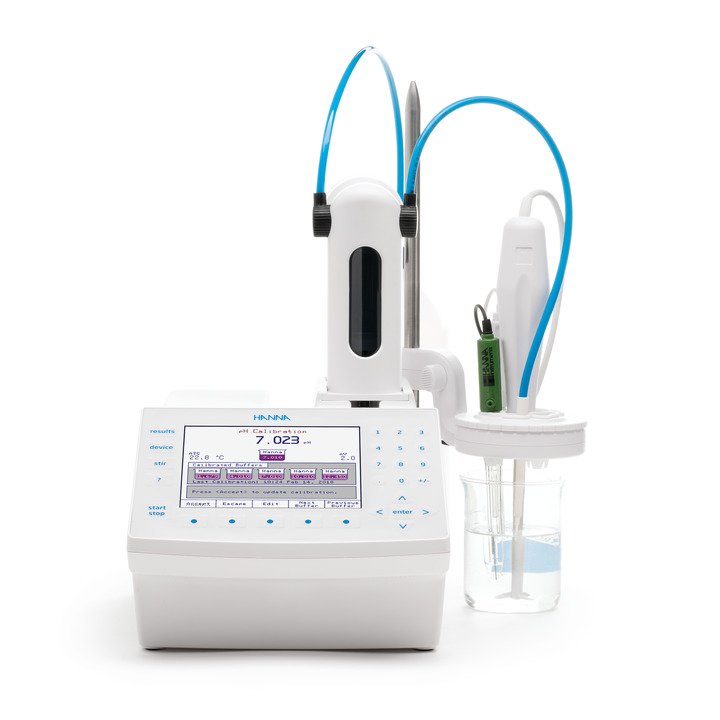
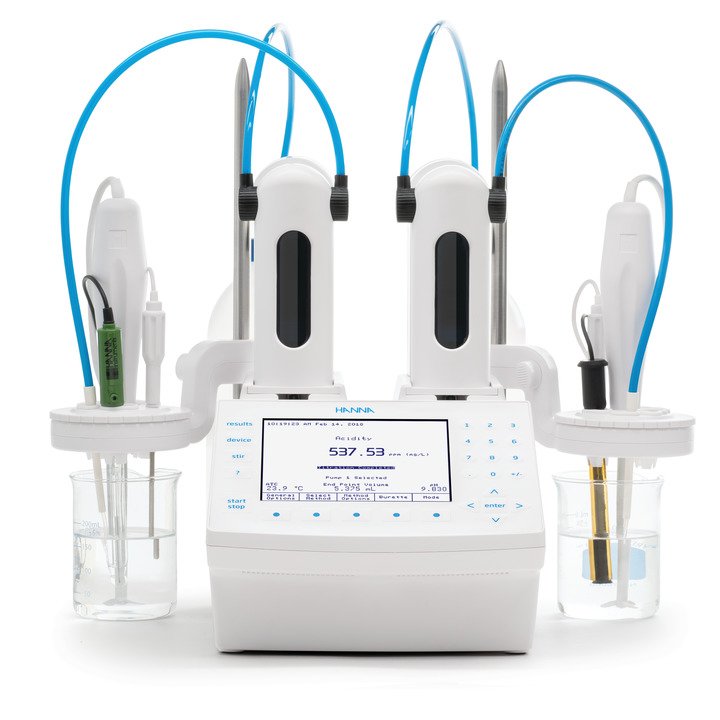
In der analytischen Chemie nutzt man die Titration, um die Konzentration einer Substanz, Analyt genannt, nachzuweisen. Die Titration ist ein quantitativer Nachweis eines Analyten in einer Lösung durch seine vollständige Reaktion mit einem Reagenz. Bei einer Titration wird ein Reagenz (der Titrant) langsam zu einer Lösung, welche die nachzuweisende Substanz (den Analyt) enthält, zugegeben. Wenn das Reagenz zugegeben wird, läuft eine chemische Reaktion zwischen Titranten und Analyten ab. Der Punkt, an dem die Reaktion vollständig abgelaufen ist und eine äquivalente Menge des Titranten und des Analyten vorliegt (ein
stöchiometrisches Gleichgewicht), wird Äquivalenzpunkt genannt. Dieser kann mittels eines chemischen Indikators, welcher ebenfalls in der Lösung vorgelegt wird, bestimmt werden. Eine weitere Möglichkeit ist die Bestimmung mithilfe der Messung von physikalischen Änderungen der Lösung wie die des pH-Wertes, des Elektrodenpotentials, der Leitfähigkeit oder der Absorption von Licht (Färbung). In der Praxis bedeutet eine abrupte Änderung dieser physikalischen Werte das Ende der Titration, Endpunkt genannt.