-
Produkte
- pH/Redox-Messgeräte
- Leitfähigkeit & TDS Messgeräte
- Sauerstoffmessgeräte
- Multiparameter-Messgeräte
- ISE-Messgeräte
- Titrationssysteme
- Photometer
- Tester
- Hygrometer & Luxmeter
- Elektroden & Sonden
- Bluetooth Elektroden
- Lösungen & Reagenzien
- Thermometer
- Trübungsmessgeräte
- Magnetrührer
- Refraktometer
- Chemische Testkits
- Prozesstechnik
- Zubehör
- Sonderangebote
- Anwendungsbereiche
- Service
- Über Uns
- Karriere
- Blog
- Privat-Kunden
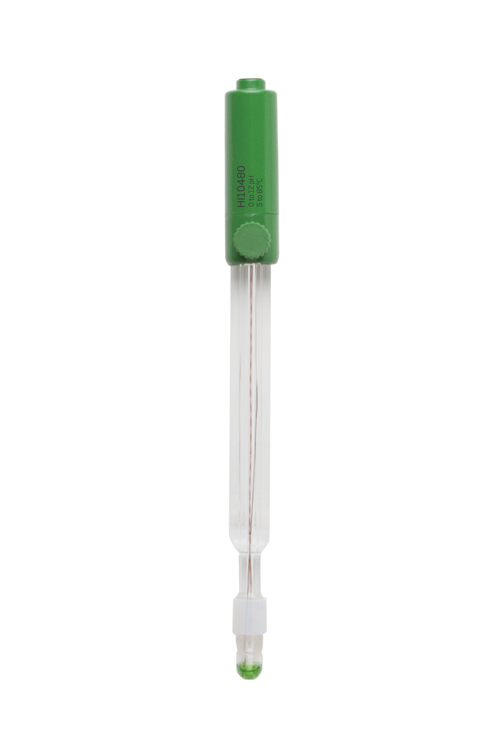
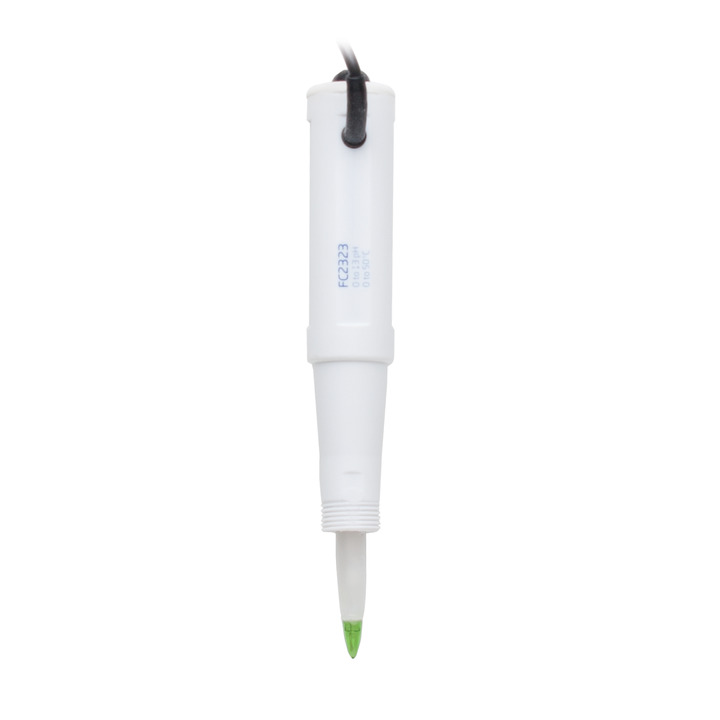
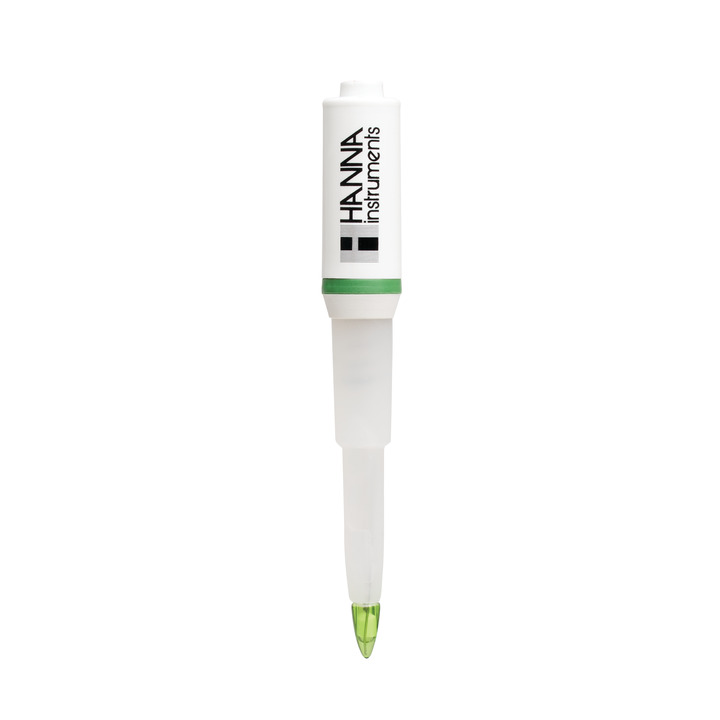
pH-Elektrode / Redox-Elektrode
Bei der elektrochemischen pH-Messung verhält sich die Spannung der Messelektrode proportional zur Aktivität der Wasserstoffionen und die Referenzelektrode besitzt eine konstante, bekannte Spannung. Das pH-Messgerät misst die Spannungsdifferenz zwischen beiden Elektroden in mV. Anschließend konvertiert die interne Elektronik das Messergebnis in pH.
Die pH-Messkette
Die Messelektrode besteht aus einem Glasrohr mit einer dünnen Glasmembran, die am Ende empfindlich auf H+-Ionen reagiert. In Kontakt mit einer wässrigen Lösung wird eine dünne Gelschicht um die Außenwand der Membran gebildet. Eine zweite dünne Gelschicht bildet sich auf der Innenwand der Membran, da die Elektrode mit einer Elektrolytlösung, einem internen Puffer bei konstantem pH-Wert, gefüllt ist. Das Potential an der Innenseite der Membran bleibt während der Messung konstant. Je nach Konzentration der H+-Ionen in der gemessenen Probe diffundieren diese Ionen, die um oder in der äußeren Gelschicht verbleiben, innerhalb oder außerhalb dieser Schicht und erzeugen so eine negative (basische Proben) oder positive (saure Proben) Ladung. Der Ladungsunterschied zwischen den beiden Membranwänden erzeugt das Potential der pH-Elektrode. Dieses Potential ist jedoch nicht ausreichend und eine zweite Elektrode ist erforderlich, um ein stabiles Referenzpotential für die pH-Elektrode bereitzustellen. Die Referenzelektrode besteht aus einem gegen H+-Ionen unempfindlichen Glas und einem flüssigen Übergang, einem porösen Element (auch Diaphragma oder Verbindung genannt) in Kontakt mit der Probe,
durch das der innere Elektrolyt in die Probe fließen kann. Wenn beide Elektroden (Messung und Referenz) in eine Probenlösung getaucht werden, entsteht eine galvanische Zelle. Die Potentialdifferenz zwischen den beiden Elektroden ist das vom pH-Meter verwendete Signal.
Redoxpotentialmessung
Das Redoxpotential (oder kurz Redox) bezeichnet die Fähigkeit eines Stoffes zur Oxidation oder zur Reduktion. Währdend der pH-Wert die Wasserstoffionenaktivität einer Lösung wiedergibt, steht das Redoxpotential für die Elektrodenaktivität. Die Redoxmessung erfolgt mit einem pH-Meter im mV-Bereich. Eine Redox-Elektrode besteht aus einem inerten Metall, das Elektroden sowohl aufnehmen als auch abgeben kann. Im Allgemeinen werden Platin und Gold verwendet. Goldelektroden werden für eisen- oder chromhaltige Redox-Titrationen oder für Messungen in sehr sauren Lösungen empfohlen. Platinelektroden werden zur Messung von stark oxidierenden oder chloridhaltigen Lösungen und Redox-Titrationen verwendet. Die Silberkopf-Redox-Elektrode findet Anwendung bei der argentometrischen Titrationen von Halogeniden.